Utlenianie melatoniny tlenem singletowym (O2 (1Δg)) prowadzi do cyklicznej 3-hydroksymelatoniny 1. Otrzymaliśmy szereg analogów melatoniny z podstawnikami karbaminianowymi w miejscu grupy metoksylowej w pozycji 5 pierścienia indolowego. Związki te, analogicznie do melatoniny, ulegają utlenieniu tlenem singletowym w wyniku czego otrzymaliśmy odpowiednie cykliczne pochodne 3-hydroksymelatoniny, które posiadają heterocykliczny układ 2,3,8,8a-tetrahydropirrolo[2,3-b]indolu. Stanowi on szkielet struktury charakterystyczny dla fizostygniny 2 i jej podobnych związków, które są potencjalnymi inhibitorami acetylocholinoesterazy (AChE) i butyrylocholinoesterazy (BChE) stosowanymi w leczeniu choroby Alzheimera.
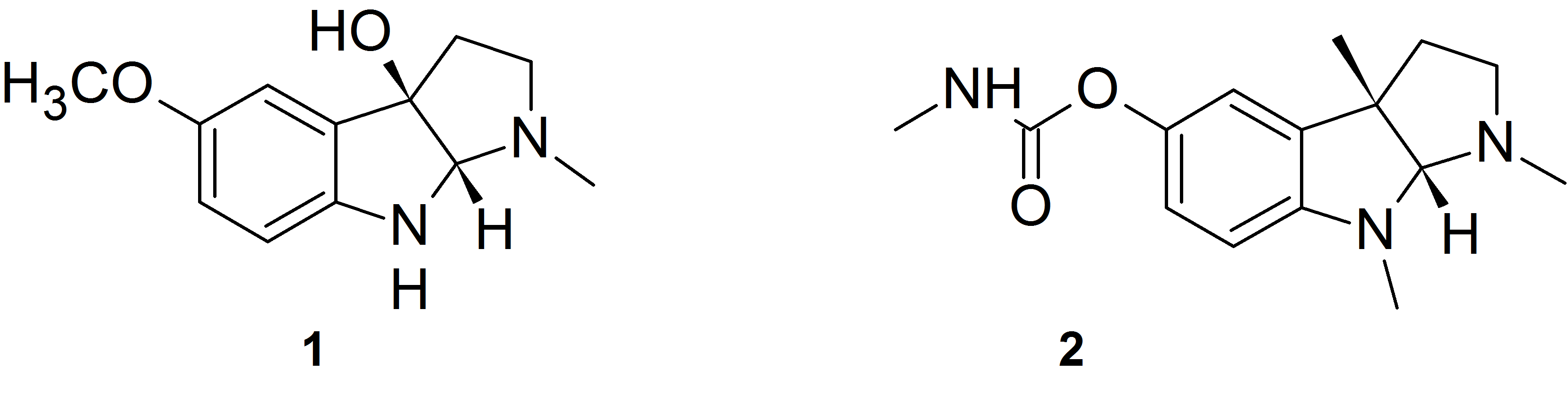
Potwierdziliśmy bardzo wysoką aktywność inhibicji serii otrzymanych związków przeciw AChE i BChE na ludzkich erytrocytach i surowicy.
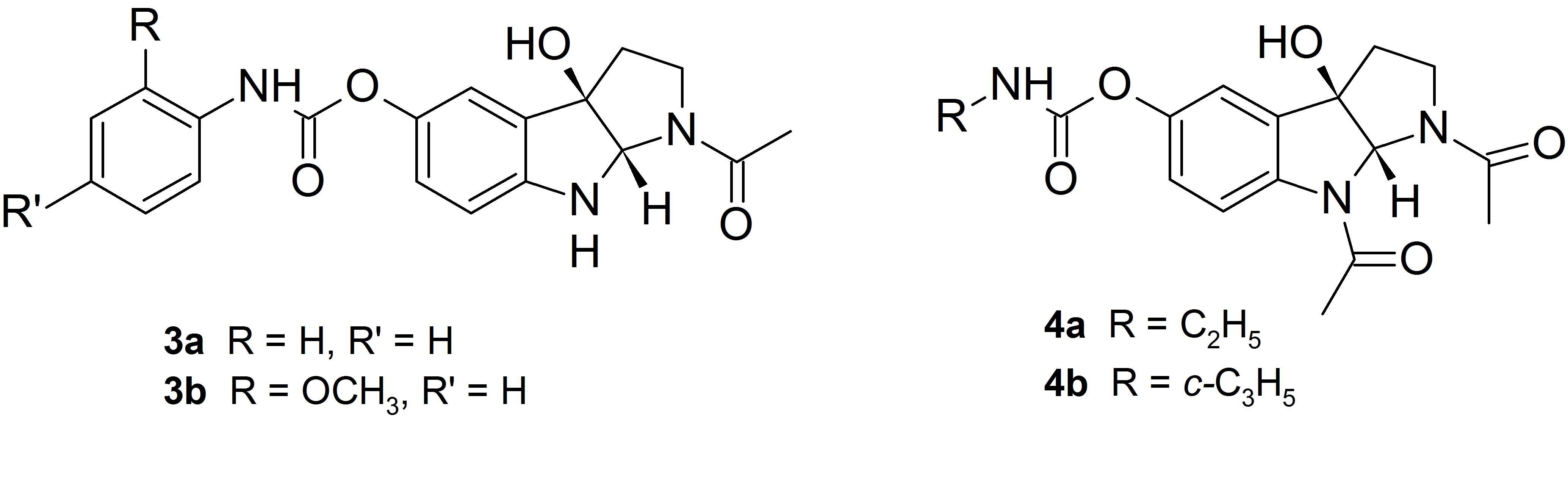
Najlepszymi inhibitorami AChE okazały się fenylo- i metoksyfenylokarbaminanowe pochodne 3a i 3b, z kolei analogi alkilokarbaminianowe 4a i 4b wykazały selektywność w kierunku inhibicji butyrylocholinoesterazy.
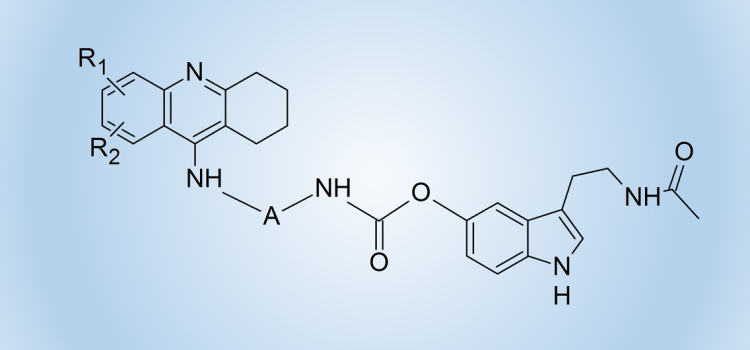
Wykorzystując ideę podstawienia melatoniny poprzez wiązanie karbaminianowe od strony atomu tlenu układu fenolowego oraz korzystając z koncepcji związków hybrydowych, otrzymaliśmy heterodimery znanego leku stosowanego w terapii choroby Alzheimera – takryny z melatoniną (związki o strukturze 5) oraz produktem utleniania melatoniny (związki o strukturze 6).
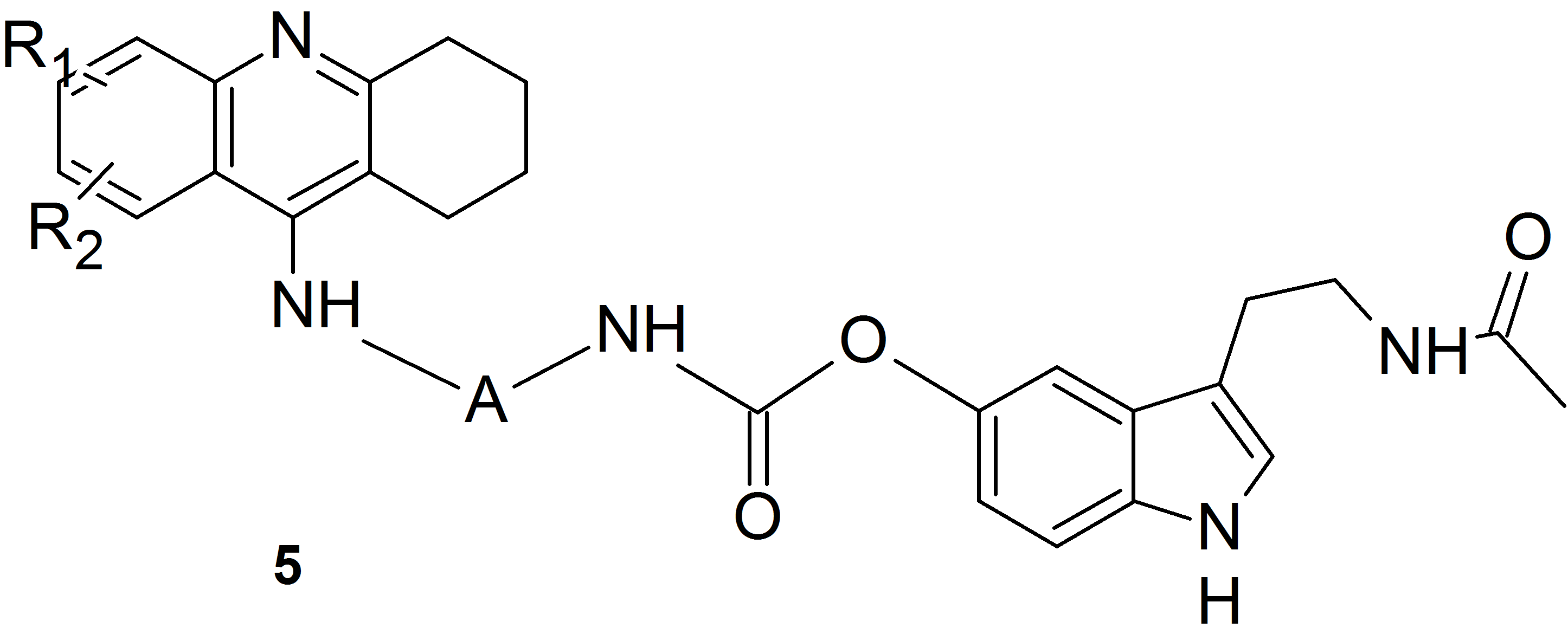
Otrzymaliśmy serię pochodnych różniących się sposobem podstawienia pierścienia takryny oraz długością łańcucha metylenowego łączącego fragment terahydroakrydyny z układem melatoniny.
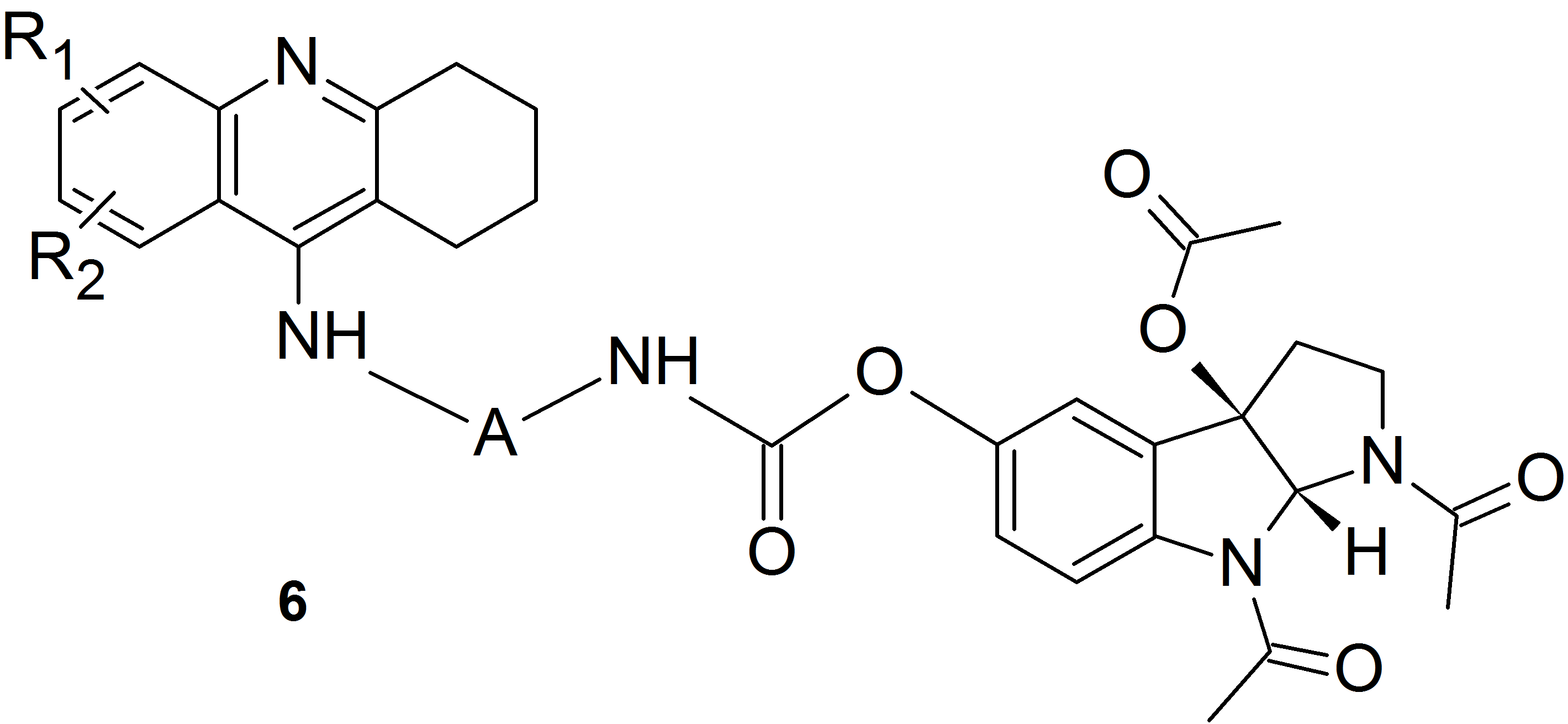
Heterodimery te charakteryzują się zdecydowanie lepszą aktywnością biologiczną w kierunku hamowania cholinoesteraz od dotychczas znanych pochodnych zawierających układ melatoniny lub produktów utleniania melatoniny oraz układy melatoniny i tetrahydroakrydyny połączone linkerem zawierającym wiązanie amidowe.
Otrzymane przez nas nowe hybrydowe inhibitory cholinoesteraz objęte są ochroną patentową i mogą znaleźć zastosowanie w łagodzeniu i/lub leczeniu schorzeń neurodegeneracyjnych, w tym choroby Alzheimera.
Siwicka A., Molęda Z., Wojtasiewicz K., Zawadzka A., Maurin J. K., Panasiewicz M., Pacuszka T., Czarnocki Z. „The oxidation products of melatonin derivatives exhibit acetylcholinesterase and butyrylcholinesterase inhibitory activity” J. Pineal Res., 45, 40-49 (2008)
Molęda Z., Wojtasiewicz K., Panasiewicz M., Czarnocki Z. „Selective inhibition of butyrylcholinesterase by singlet oxygen generated melatonin derivatives” J. Pineal Res., 49, 55-59 (2010)
Zawadzka A., Łozińska I., Molęda Z., Panasiewicz M., Czarnocki Z. „Highly selective inhibition of butyrylcholinesterase by a novel melatonin–tacrine heterodimers” J. Pineal Res., 54, 435-441 (2013)
Zawadzka A., Czarnocki Z., Łozińska I., Molęda Z., Panasiewicz M. „Novel Hybrid Cholinesterase Inhibitors” US Patent No.: 8,841,453 B2; Sep. 23, 2014.
Zawadzka A., Czarnocki Z., Łozińska I., Molęda Z., Panasiewicz M. „Novel Hybrid Cholinesterase Inhibitors” EP No.: 2 714 658 B1; Apr. 29, 2015.
Zawadzka A., Czarnocki Z., Łozińska I., Molęda Z., Panasiewicz M. „New cholinesterase inhibitors of hybrid structure” PL Patent No.: 219106 B1; Mar. 31, 2015.