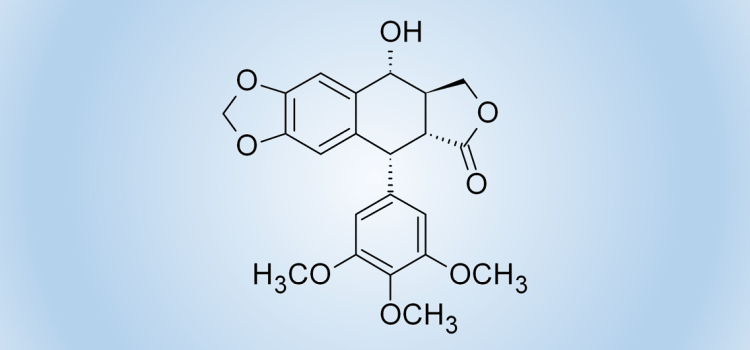
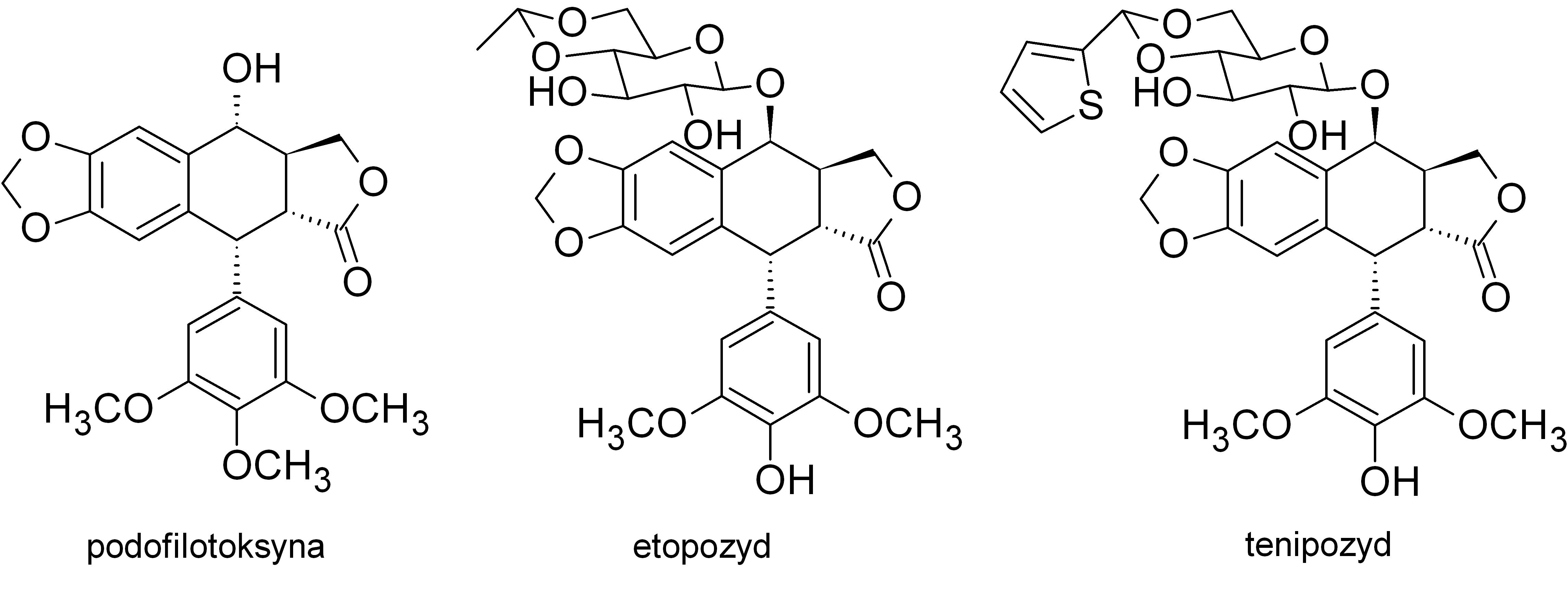
Lignany to liczna grupa roślinnych metabolitów wtórnych, składających się z dwóch fragmentów fenylopropanoidowych. Najczęściej badane są pochodne arylotetralinowe, albowiem wykazują one interesujące właściwości antybakteryjne i przeciwwirusowe. Szczególnie cenna okazała się podofilotoksyna, której półsyntetyczne pochodne etopozyd i tenipozyd znalazły szerokie zastosowanie w chemioterapii nowotworów.
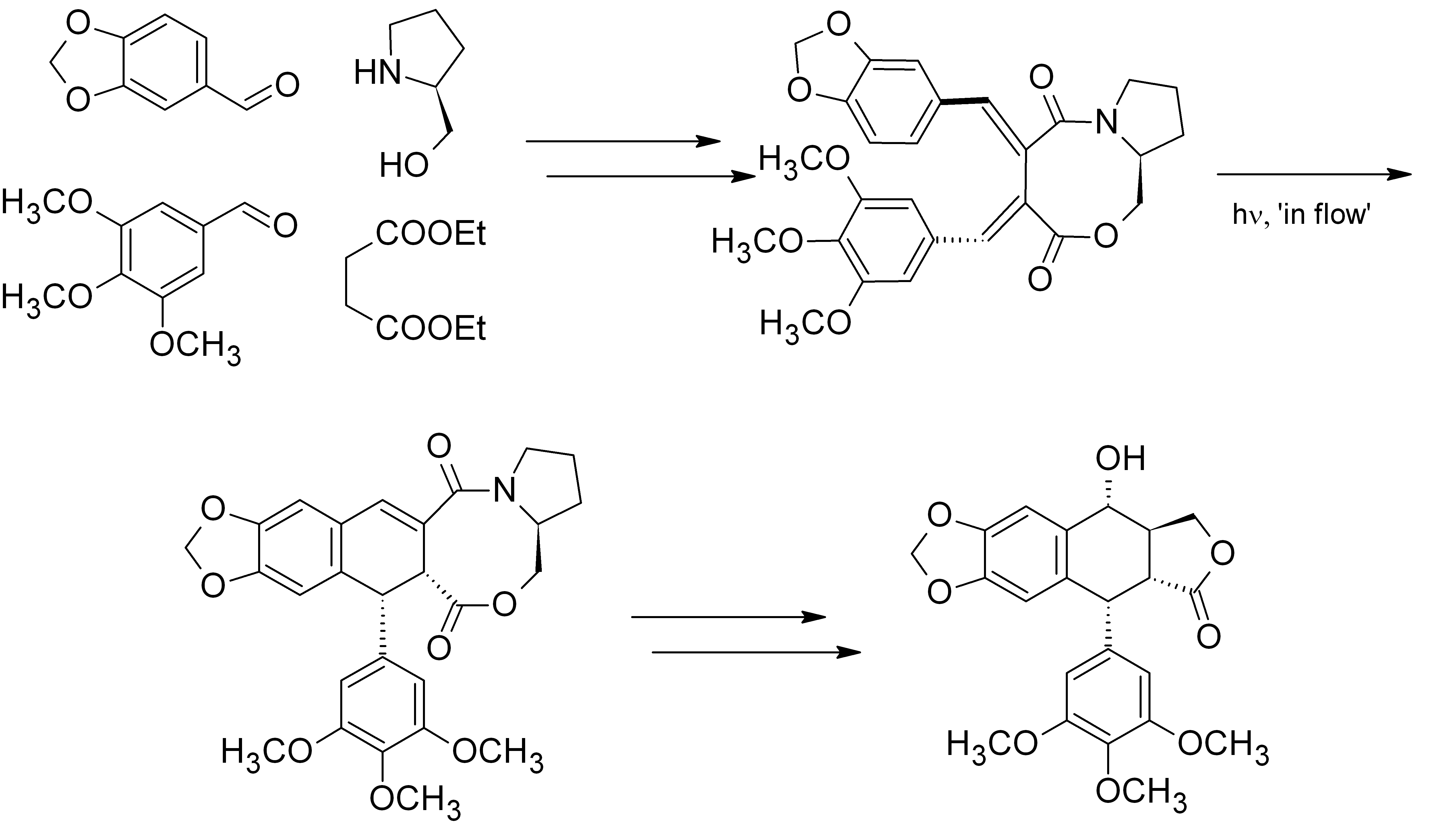
Opracowaliśmy nową strategię stereoselektywnej syntezy cyklolignanów z grupy podofilotoksyny. Kluczowym etapem syntezy była fotocyklizacja chiralnych, atropoizomerycznych 1,2-bis-benzylidenobursztynianów. Doskonałym pomocnikiem chiralnym okazał się L-prolinol. Cenną modyfikacją metody było opracowanie warunków fotocyklizacji w przepływie, co znacznie zwiększyło wydajność kluczowego etapu i ograniczyło powstawanie produktów rozkładu.
W kilku dalszych etapach z powodzeniem zakończyliśmy formalną syntezę (-)-podofilotoksyny, a także kilku innych interesujących pochodnych.
Krawczyk K.K., Madej D., Maurin J.K., Czarnocki Z., „L-Prolinol as a chiral auxiliary in the photochemical synthesis of a new aryltetraline lignan analogue” Tetrahedron: Asymmetry 22 (10), 1103-1107 (2011)
Lisiecki K., Krawczyk K.K., Roszkowski P., Maurin J.K., Czarnocki Z., „Formal synthesis of (-)-podophyllotoxin through the photocyclization of an axially chiral 3,4-bisbenzylidene succinate amide ester – a flow photochemistry approach” Organic & Biomolecular Chemistry 14, 2, 460-469 (2015)